第二节 类质同象对宝石化学成分的影响
一、类质同象的概念
正如前节所述,矿物化学成分在一定范围内是可以变化的。这主要是由于两方面的原因,一是类质同象替代;二是外来物质机械混入,即含有不进入晶格的包体。所谓类质同象,是指在晶体结构中部分质点被其他性质类似的质点所替代,仅使晶格常数和物理化学性质发生不大的变化,而晶体结构保持不变的现象。
如果相互替代的质点可以任意比例替代,即替代是无限的,则称为完全类质同象,此时它们可以形成一个成分连续变化的类质同象系列。例如,橄榄石(Mg,Fe)2(SiO4)中的Mg2+↔Fe2+之间的替代,当二者都存在时,可统称为橄榄石;当Mg全部被Fe替代时,便成为铁橄榄石Fe2(SiO4),Fe全部被Mg替代时,就成为镁橄榄石Mg2(SiO4)。又如,斜长石(由钙长石分子和钠长石分子组成)中Na++Si4+↔Ca2++ A13+的替代,都可以在一定条件下形成完全类质同象。
如果质点替代只局限于一个有限的范围内,则称为不完全类质同象。例如闪锌矿(ZnS)中的Zn2+可部分地(最多26%)被Fe2+所替代,在这种情况下,Fe2+被称为类质同象混人物。此外,当相互替代的质点电价相同时(如Na+↔K+,Fe2+↔Mg2+)称为等价类质同象,如果相互替代的质点电价不同(如A13+替代Si4+)则称为异价类质同象,当然后者必须有电价的补偿以维持电价平衡。比如在钠长石(NaAlSi3O8)—钙长石(CaAl2Si2O8)系列中,A13+与Si4+之间的替代和Na+与Ca2+之间的替代都是异价的,但由于这两种替代同时进行,所以替代前后总电价仍是平衡的。
二、类质同象的条件
形成类质同象的条件,一方面取决于质点本身的性质,如原子或离子半径大小、电价、离子类型、化学键性等;另一方面也取决于外部条件,如温度、压力和介质条件等。
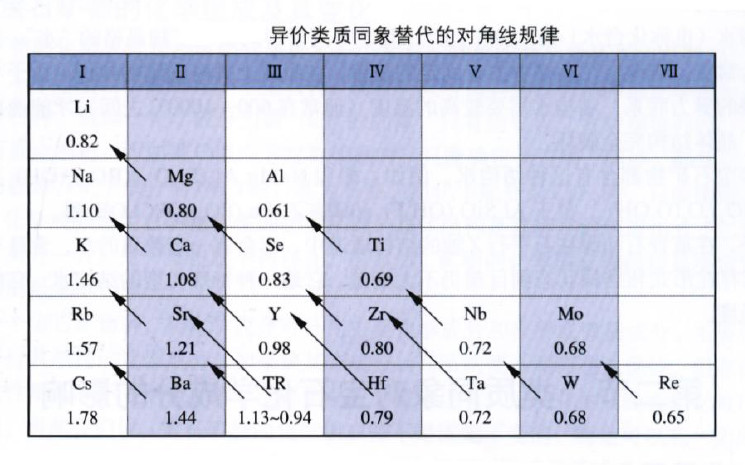
1.质点大小相近
相互替代的原子或离子必须有近似的半径。一般而言,如果相互替代的质点半径相差越小,相互替代的能力越强,替换量也越大;反之则越弱、越小。在异价类质同象替代中,在元素周期表上对角线方向的阳离子半径近于相等,容易发生替代,从而存在着所谓的对角线规则(一般都是右下方的高价阳离子替代左上方的低价阳离子)。
2.电价的总和平衡
在离子化合物中,类质同象替代前后离子电价总和应保持平衡,因为电价不平衡将引起晶体结构的破坏。对于异价类质同象,电价的平衡可以通过下列方式完成:①电价较高的阳离子被数量较多的低价阳离子替代(如云母中3 Mg2+替代2 A13+),或者相反;②成对替代,即高价阳离子替代低价阳离子的同时另有其他低价阳离子替代高价阳离子,使离子总电位达到平衡,如斜长石中Na++Si4+→Ca2+ +A13+;蓝宝石中Fe2++Ti4+→2A13+等;③高价阳离子替代低价阳离子伴随高价阴离子替代低价阴离子,如磷灰石(Ca2+,Ce3+)5(PO4)3,(F,O)中Ce3+替代Ca2+ ,伴随O2-→替代F+④低价阳离子替代高价阳高子,所亏损的电价由附加阳离子平衡,如绿松石中Li→Be2+、Fe2++ A13+所亏损的正电荷分别由半径较大的Cs+和Na+进人绿松石结构通道中平衡。
3.相同的化学键性
类质同象替代一般是在同种离子类型之间发生的,如果离子类型不同则很难发生类质同
象。因为离子类型不同,极化力强弱各异。惰性气体型离子易形成离子键,而铜型离子则趋
向于共价键结合。例如在硅酸盐宝石矿物中,A1—O之间和Si—O之间都主要是共价键,因而经常出现A13+对S4+产的替代。又如Ca2+(惰性气体型)和Hg2+(铜型)虽然电价相同、半径相似,但因离子类型不同,所形成键性各异,所以它们之间不产生类质同象替代,这就是为什么在硅酸盐中很难发现Ca↔Hg等类质同象的原因。
4.热力学条件
介质的温度、压力和组分浓度等外部条件对类质同象的发生也起重要作用。一般来说,
温度升高时类质同象替代的程度增大,温度下降则类质同象替代减弱。如在高温下碱性长石
中K和Na可以互呈类质同象替代而形成(K,Na)A1Si3O8或(Na,K)A1Si3O8固溶体;但在低温下则发生固溶体分离,而形成由钾长石KAl Si3O8和钠长石NaAl Si3O8两种矿物组成的条纹长石。压力的增加往往会限制类质同象替代的范围,并促使固溶体分离。组分的浓度对类质同象也会有影响,如在磷灰石的形成过程中,若P2O5的浓度很大,而Ca含量不足,则Sr和Ce族元素可以进入晶格占据Ca的位置,从而使磷灰石中聚集相当大量的稀有或分散元素。
三、类质同象对宝石矿物物理性质的影响
1.对宝石矿物颜色的影响
类质同象对于宝石矿物具有非常重要的意义,因为大部分宝石矿物是由于少量类质同象
混人物而呈现各种美丽诱人颜色的。现举几个具代表性的实例。
(1)刚玉
纯净的刚玉矿物是无色的,其化学成分为A12O3当其中A13+被微量Cr3+替代(即Cr3+→A13+)时则呈现玫瑰红—红色色调,称红宝石;当其中A13+被微量Ti4+和Fe2+等替代(即Ti4++Fe2+→2A13+)时则呈现漂亮的蓝色,称蓝宝石。Fe2+和Ti4+含量越高则蓝宝石的蓝色越深,反之越浅。我国山东蓝宝石的深蓝色就是其中含有过多的Fe所致。
(2)绿柱石
绿柱石的化学成分为Be3A12Si6O18,纯净的绿柱石是无色的。当绿柱石的Be、A1被不同元素替代时,可以呈现不同的颜色,如绿色、黄绿色、蓝色、黄色和粉红色等。当绿柱石中含有Cr、V等元素时,就呈现美丽的翠绿色,这就是祖母绿;当含有Fe和Sc等元素时,呈现漂亮的蓝色,这就是海蓝宝石;当含有Cs、Mn等元素时则呈现粉红色—红色;当含有Fe或U时则呈现黄色色调或黄绿色色调。
(3)电气石
电气石的化学成分为(Na,Ca)R3A16Si6O18 (O,OH,F)4,式中R主要为Mg、Fe、Cr、Li、A1、Mn等,这些元素之间复杂的类质同象替代导致了电气石的化学成分十分复杂,也导致了电气石具有各种各样的颜色。在电气石化学组成中,Mg2+—Fe2+之间和Fe2+—Li+、A13+之间呈完全类质同象,其中3Fe2+→2A13++Li+替代的负电荷不足,由附加阴离子中OH-被O2-替代来补偿;Mg和Li之间的替代,以及Mg、Fe和Cr、Mn之间的替代都是不完全的。当电气石化学组成中R位以Fe为主时,则电气石呈深蓝色甚至黑色;当R位以Mg2+为主时则电气石呈黄色—褐色;当电气石富含Li和Mn时则呈玫瑰色或浅蓝色;当电气石富含Cr时则呈深绿色。
(4)翡翠
翡翠主要由硬玉矿物组成,硬玉的化学组成为NaAISi2O6。纯净的硬玉岩是白色的,但当硬玉化学组成中的A1被不同元素替代时,则显示不同的颜色:①当硬玉化学组成中的A1 被Cr、V替代时,则翡翠呈诱人的绿色,绿色的深浅与替代程度有关,当Cr的质量分数在1%~2%之间时,翡翠的颜色最美丽,呈浓艳的绿色,且为半透明,但当Cr含量很高时,翡翠则呈不透明的黑绿色,即所谓的干青种翡翠;②当硬玉化学组成中的A13+被Fe3+替代时,则翡翠呈发暗的绿色(不像含Cr翡翠那么鲜艳、明快,而是呆板、缺乏灵气),若Fe3+只是少量替代A13+,翡翠呈浅绿色,若Fe3+大量替代A13+,则翡翠呈暗绿色,甚至墨绿色;③当硬玉化学组成中的A13+同时被Fe3+和Cr3+替代时,翡翠的颜色则视Fe3+和Cr3+相对比例而定。Cr3+较多则绿色鲜艳一些,Fe3+较多时则绿色偏暗一些;④当硬玉化学组成中的A13+同时被Fe2+和Fe3+替代时,则翡翠呈紫色,也有人认为翡翠的紫色是由于含有Mn或K造成的。
2.对宝石矿物折射率、相对密度和硬度的影响
类质同象不但使宝石矿物的化学成分发生一定程度的改变,而且也在一定程度上影响它
的折射率和相对密度等物理性质。现举几个实例加以说明。
(1)电气石
如前所述,电气石的颜色基本上受类质同象的种类和程度的影响,实际上电气石的相对
密度和折射率也与类质同象有密切联系。镁电气石NaMg3A16Si6O18(BO3)3(OH)4中的Mg2+和锂电气石Na(Li,A1),AI6O18 (BO3)3 (OH,F) 4中的Li+、A13+都有可能被Mn2+和Fe2+替代。研究表明,随着电气石成分中Mn、Fe的增加,电气石的相对密度(3.03~3.25)、折射率(n0=1.635~1.675,ne=1.610—1.650)和双折射率(0.016~0.033)都随之增大。
(2)绿柱石
在绿柱石Be3A12Si6O18。组成中,当Be被Li替代(即Li+→Be2+)时,所亏损的电荷主要由半径较大的Cs+进入绿柱石的结构通道来平衡。含Cs越高,则绿柱石的相对密度(2.6~2.9)、折射率(n0=1.566~1.602,ne=1.562~1.594)和双折射率(0.004~0.009)也越高,Cs(Cs2O)的质量分数最高可达4.13%。
(3)橄榄石
在橄榄石(Mg,Fe) 2SiO4组成中,Fe和Mg可以呈完全类质同象(Mg2+~Fe2+),随着其中Fe含量增加,不但橄榄石的颜色加深,而且它的相对密度(3.32~3.37)和折射率(1.65~1.69)也逐渐增大,摩氏硬度(HM=6.5~7)也略有增加。
(4)黄玉
在黄玉Al2SiO4 (F,OH) 2的化学组成中,F—作为附加阴离子有时可被OH-所替代,最高时可达F含量的1/3(与黄玉形成时的温度有关)。研究表明,随着OH-对P-替代程度的增加,黄玉的相对密度(3.5~3.6)逐渐减小,折射率(1.603~1.638)逐渐增大。